细则落地满半年,人类遗传资源监管有何变化?
2024.01.31 周烽 孙邦娇 李明轩
2019年《人类遗传资源管理条例》(“《条例》”)颁布后,人类遗传资源监管合规一直是医药健康领域的热点议题。监管部门和生物医药行业不断互动、摸索,在监管实践中寻找人类遗传资源的安全和合理利用之间的最佳平衡点。2022年3月,科学技术部(“科技部”)综合监管实践中遇到的问题和意见,公布了《条例》的实施细则征求意见稿,引发业界热烈的学习和讨论。历经一年多的等待,科技部终于在2023年6月1日正式颁布了《人类遗传资源管理条例实施细则》(“《细则》”),并于2023年7月1日正式施行。
目前,《细则》已施行超过半年。这半年多来,监管部门在人类遗传资源监管方面有什么值得注意的变化,企业在后续人类遗传资源合规方面需要关注哪些内容?本文对此进行了总结、回顾和评价,希望对于生物医药企业理解和适应新的人类遗传资源监管体系有所裨益。
1.《细则》亮点回顾
《细则》颁布后,业界已有大量解读和总结,读者可参考本所于2023年6月12日发表的“君合法评丨靴子落地--《人类遗传资源管理条例实施细则》颁布”一文。此处仅简要总结《细则》的一些核心亮点:
(1)限缩外方单位的界定:根据《条例》,外方单位需要利用我国人类遗传资源开展科学研究活动的,需要与中方单位合作并经过科技部批准或者备案。外方单位被定义为“外国组织及外国组织、个人设立或者实际控制的机构”。《细则》出台前,外方单位的认定非常广泛,企业中仅有少量外资成分,也可能被认定为外方单位。《细则》对于“设立”或“实际控制”的认定参照《公司法》的定义,即外资持股50%以上,或虽然持股不到50%,但能对机构的决策、管理等行为进行支配或者施加重大影响。此外,《细则》首次规定“设在港澳的内资实控机构视为中方单位”。
(2)优化人遗信息的界定:《条例》规定,人类遗传资源信息(“人遗信息”)是指利用人类遗传资源材料(“人遗材料”)产生的数据等信息资料。如果做字面解读,利用人遗材料产生的数据,例如血常规、尿常规、肝肾功能等一般实验室检查信息,也可能被归入人遗信息,而这些信息并不含有人类基因数据。《细则》将人遗信息的定义限缩为利用人遗材料产生的“人类基因、基因组数据等信息资料”,并且专门明确人遗信息“不包括临床数据、影像数据、蛋白质数据和代谢数据”。
(3)放宽外方伦理审查证明资料要求:在人类遗传资源国际合作项目中,外方单位的伦理审查证明资料在《细则》出台前为行政许可的申请材料之一,而实践中该等文件在境外可能并非必需,外方单位往往难以取得该等文件。《细则》就此提供了豁免路径:如外方单位确无法提供所在国(地区)伦理审查证明材料的,可以提交外方单位认可中方单位伦理审查意见的证明材料。
(4)放宽国际合作临床试验适用备案的适用条件:此前的监管实践中,适用国际合作临床试验备案的前提是相关临床试验“在临床机构”进行,并且进一步要求所涉及的人类遗传资源在临床机构采集,并在临床机构或者其委托的单位进行检测、分析和剩余样本处理。实践中,第三方“检测、分析和剩余样本处理”机构,往往不是由临床机构委托,而是由临床试验方案指定。《细则》规定,在临床机构采集人类遗传资源并由临床试验方案指定的境内单位进行检测、分析和剩余样本处理也满足备案条件。
(5)明确适用安全审查的情形:《条例》规定,将人遗信息对外提供或者开放使用,可能影响我国公众健康、国家安全和社会公共利益的,应当通过科技部组织的安全审查。但是,《条例》并未明确哪些情形需要适用该等审查。《细则》明确,需要通过安全审查的为以下四种情形:(i)重要遗传家系的人遗信息;(ii)特定地区的人遗信息;(iii)人数大于500例的外显子组测序、基因组测序信息资源;和(iv)可能影响我国公众健康、国家安全和社会公共利益的其他情形。
总体而言,《细则》是对《条例》的有益补充和细化,针对人类遗传资源监管过程中出现的各种问题调整了监管重点,对于监管风险较低的领域予以放行。《细则》出台后,业界普遍持积极认可态度,认为其切实履行了“放管服”要求,使我国人类遗传资源监管趋向科学合理。
2. 新平台上线
2023年7月1日起,名为“人遗管理智慧化系统”的人类遗传资源管理新系统(https://apply.hgrg.net,“新平台”)正式上线,原管理平台(https://grants.most.gov.cn/grants,“原平台”)逐步停用。具体而言:原平台在2023年6月30日停止受理除人类遗传资源材料出境、信息对外提供或开放使用事先报告三个事项以外的申请,并在2023年9月28日停止了余下三个申请事项的受理。2023年9月28日以后,所有申请均在新平台上受理,原平台仅负责消纳已受理的各项申请。
新平台是科技部为人类遗传资源监管体系建设的重要配套基础设施,对于各项人类遗传资源行政许可事项的受理和及时获批将发挥积极作用。
3. 人遗办成为历史,生物技术中心尚待转隶属
2023年7月1日,科技部发布《关于调整人类遗传资源管理工作相关事宜的公告》,正式中止[1]“人类遗传资源管理办公室”(“人遗办”)的运行。自1998年成立以来,“人遗办”一直在人类遗传资源监管中发挥核心作用,是生物医药企业耳熟能详的监管机构,现在正式完成了它的历史使命。
科技部委托中国生物技术发展中心(“生物技术中心”)替代人遗办继续开展人类遗传资源管理相关技术工作。根据2023年3月全国人大通过的国务院机构改革方案,生物技术中心将划入国家卫生健康委员会。据我们了解,目前生物技术中心的转隶属工作正在进行。生物技术中心、卫健委和科技部将互相协调,确保转隶属过渡期内行政审批工作平稳有序。
值得注意的是,科技部已废除了“中国人类遗传资源管理办公室”(行政审批用章)、“中国人类遗传资源管理办公室审批专用章”(出口出境证明用章),并启用了“科技部人类遗传资源行政许可受理专用章”、“科技部人类遗传资源行政许可专用章”和“科技部人类遗传资源备案专用章”,但是并未提及启用生物技术中心的相关行政审批用章。对于生物技术中心正式划转卫健委后如何继续支持人类遗传资源监管工作,有待科技部和卫健委进一步出文予以明确。
我们倾向于认为,《细则》系在国务院机构改革方案出台后公布,应已经充分考虑了机构改革对于人类遗传资源监管工作的影响,考虑到新平台上线时间也不长,因此由于生物技术中心的转隶属工作而对人类遗传资源监管方式再次做出重大调整的可能性较低。
4. 新版《行政指南》和《问答》出台
2023年7月14日,科技部发布《关于更新人类遗传资源行政许可事项服务指南、备案以及事先报告范围和程序的通知》,公布了与《细则》配套的行政服务指南(“《行政指南》”),详细列出了人类遗传资源的采集许可、保藏许可、材料出境许可、国际科研合作许可、国际合作临床试验备案、信息对外提供或开发使用报告等六大事项服务指南。
2023年9月12日,科技部又结合《细则》要求,提炼申请人在办理人类遗传资源行政审批和备案等事项时咨询的常见问题,发布了《人类遗传资源管理常见问题解答》(“《问答》”),供申请人在申报过程中进行参考。历史上,科技部曾就人遗监管编纂过申报提示、系列问答一和系列问答二,解答申请人在人类遗传资源监管中的各类常见问题。《问答》发布后,往期发布的常见问题解答同时作废,统一被《问答》取代。随着人类遗传资源申报的常态化,我们预计《问答》也会根据监管实践不断更新,并且一些共性问题可能被纳入《行政指南》或更高层级的法律条文。
《行政指南》和《问答》包含了人类遗传资源监管行政事项的诸多细节要求,读者可重点关注以下内容:
(1) 对人遗材料和人遗信息进行进一步释义
《条例》和细则的定义
《行政指南》和《问答》的进一步释义
人类遗传资源材料
人类遗传资源材料指含有人体基因组、基因等遗传物质的器官、组织、细胞等遗传材料
《行政指南》:人类遗传资源材料包括所有类型细胞、全血、组织/组织切片、精液、脑脊液、胸/腹腔积液、血/骨髓涂片、毛发(带毛囊)等,其他不含细胞的人体分泌物、体液、拭子等无需申报。
《问答》:尿液、粪便、血清、血浆等可能含有极少量脱落、残留或游离细胞或基因的生物样本不再纳入人类遗传资源监管范围,但如果将该等材料用于科学研究进行基因、基因组、转录组、表观组及核酸类生物标志物等检测产生的人类遗传资源信息,仅在涉及国际合作、信息对外提供或开放使用事项时纳入监管。
人类遗传资源信息
人类遗传资源信息指利用人类遗传资源材料产生的人类基因、基因组数据等信息资料,但不包括临床数据、影像数据、蛋白质数据和代谢数据
《行政指南》:基因、基因组、转录组、表观组及ctDNA等核酸类生物标志物等数据信息,以及与此数据相关的疾病、人种等关联信息,其他不含人类遗传资源基因信息的数据类型无需申报。
(2) 对各人类遗传资源监管事项之间的覆盖关系予以进一步明确
实践中,一些科研项目会涉及人类遗传资源的采集、保藏、国际合作、信息对外提供或开放使用、材料出境等多各行政事项,企业往往对于同一项目是否需要同步取得不同的行政许可存在疑问。《行政指南》和《问答》就此前不太明确的行政事项之间的覆盖关系进行了解答。我们结合《条例》、《细则》、《行政指南》和《问答》将各人类遗传资源监管事项的覆盖关系总结如下:(i) 保藏许可覆盖采集许可:需要申请保藏许可的项目同时涉及采集许可的,仅需要申请保藏许可;(ii) 国合许可、备案覆盖采集许可:需要申请国际合作许可或备案活动的项目同时涉及人类遗传资源采集的,仅需要申请国际合作许可或备案;(iii) 国合许可、备案覆盖信息对外提供或开放使用时的报告和信息备份:已取得国合许可或备案的项目,中方单位向外方单位提供合作产生的人类遗传资源信息的,如国际合作协议中已约定合作产生的人遗信息由合作双方使用,不需要在信息对外提供或开放使用时单独事先报告和提交信息备份。
(3) 对合作各方的范围予以进一步明确
在监管实践中,对于涉及药物研发的国际合作项目,申办方、医疗卫生机构、合同研究组织和第三方实验室均被认定为合作各方,需要共同提交国际合作许可或备案申请。除上述四方以外的其他单位是否属于合作方,却往往存在不同意见。《问答》明确,该等单位应当“可接触到管理范围内的人类遗传资源材料或信息”且对合作项目“进行实质性参与”。以此为标准,《问答》将EDC供应商、数据统计公司、对合作项目予以赞助但是无实质性参与的外方均明确排除在合作各方外。
5. 行政许可数据分析
我们以每半年为一个期间,统计了2022年下半年、2023年上半年以及《细则》生效后半年(即2023年下半年)这三个期间的公开行政许可数据2,整理图表如下:
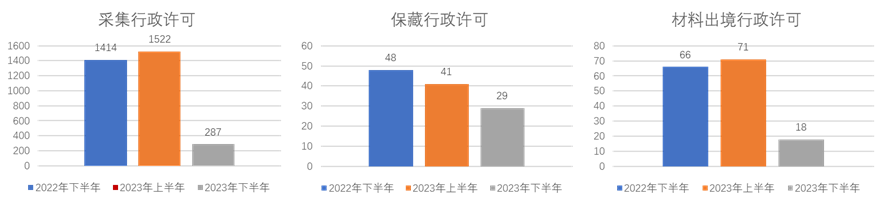
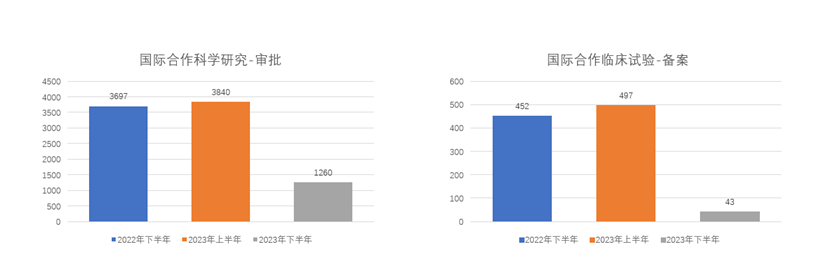
从上图可以看出,《细则》生效后,人类遗传资源相关的各项行政许可数量均大幅下降,其中下降幅度最大的是采集审批和国际合作临床试验备案,其在2023年下半年的审批数量较2023年上半年以及2022年同期的下降幅度分别在八成、九成左右。我们认为,《细则》对“人遗材料”、“人遗信息”及对“外方单位”范围的限缩可能导致一些原本需要行政许可的项目不再被纳入许可范围。此外,生物医药行业景气度下降导致新开研发项目数下降,而申请人也需要一定的时间去适应新的审批平台和审批要求。这些原因可能都对审批数量的下降产生了一定影响。
我们也统计了上述三段期间科技部发布的部分人遗相关行政许可3的平均审批时间和最长审批时间,具体见下表:
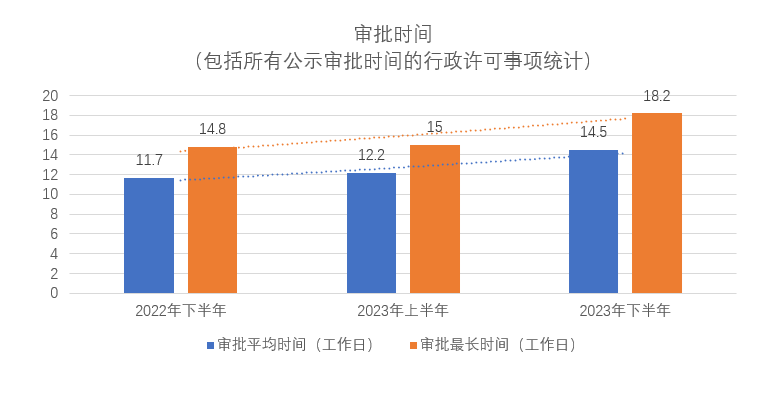
从审批时间上来看,无论是审批的平均时间,还是审批的最长时间,2023年下半年较2023年上半年以及2022年同期均有小幅延长,并且《细则》生效并未改变这一趋势。我们理解该等变化可能与申请文件的要求变化、文件审核要求更为严格及审批重点更为聚焦有关。此外,纳入行政许可的事项的数量减少也可能意味着单个事项的平均复杂程度会更高。
结 语
总体而言,《细则》出台后,科技部在行政受理线上平台、配套指南及监管体制方面都进行了积极的监管调整,这些调整已经落实到具体的行政许可流程,一个更为规范和聚焦的人遗监管体系正在形成。我们期待新的人类遗传资源监管体系能在维护我国人类遗传资源安全的同时,为生物医药领域的科研和创新赋能,鼓励探索和发展,实现我国对人类遗传资源的有效利用。
1. 科技部通知原文使用“中止”而非“终止”。
2. 此处的时间段划分按照科技部官方发布的各项行政审批(包括采集审批、保藏审批、人遗材料出境审批、国际合作科学研究审批、国际合作临床试验备案五类;人遗信息对外提供或开放使用事先报告/备份备案相关情况没有公开数据,故不在本文的统计范围内)中显示的“批准时间”进行的计算和统计。
3. 在2022年7月至2023年12月期间科技部发布的行政审批事项结果的通知中,采集审批、国际合作科学研究审批、与其他审批一起公示的出境审批通知中包含了关于“审批平均时间”以及“审批最长时间”的统计,保藏审批、国际合作临床试验备案审批、单独公示的出境审批通知中未统计前述时间数据。我们此处统计的前述两个时间仅包含了科技部已公布的“审批平均时间”以及“审批最长时间”,并在此基础上计算了三个时间段的平均“审批平均时间”以及平均“审批最长时间”,以此进行比较。由于该等基础数据不全,本统计结果仅供参考。












