进口医疗器械国产化新路径:《已获进口医疗器械注册证的产品转移中国境内企业生产有关事项公告(征求意见稿)》简评
2020.03.21 周烽 程书逸
2020年3月5日,国家药品监督管理局(以下简称“药监局”)发布了《已获进口医疗器械注册证的产品转移中国境内企业生产有关事项公告(征求意见稿)》(以下简称“《征求意见稿》”)。《征求意见稿》提供了进口医疗器械转国产化生产的便利通道,一旦实施将实质性加快进口产品的国产化。本文将对《征求意见稿》的主要内容进行介绍和评述。
一、立法背景
2017年10月8日,中共中央办公厅、国务院办公厅联合发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,明确探索医疗器械上市许可持有人制度(也称注册人制度)。截至2019年底,已有21个试点范围内的省、自治区、直辖市出台了配套制度,允许医疗器械的注册与生产相分离。尽管如此,各地的试点方案都未将进口产品纳入其中。换言之,进口医疗器械的境外注册人无法直接委托境内企业生产注册产品。如果希望实现进口医疗器械国产化生产,境外注册人须先将产品和技术许可或转让给境内企业,再由境内企业将相关产品重新进行国内注册或备案,除第一类医疗器械和部分可免于临床实验的产品外通常需要走完注册检验、临床评价、资料申报的完整流程。这使得注册人不得不就同一产品的注册重复投资、重复准备资料,延缓和制约了一些器械的国产化。
二、主要内容
根据《征求意见稿》,已获进口医疗器械注册证的第二类、第三类医疗器械/体外诊断试剂的进口医疗器械注册人(以下简称“境外注册人”)可通过其在中国境内的控股子公司等关联企业(以下简称“境内注册人”)就同一产品提交境内医疗器械注册申请。药监局允许境内注册人在提交注册申报资料时,部分申请材料可以提交进口医疗器械的原注册申报资料,以便加快注册进程。我们将具体监管要求整理如下:
适用的产品范围
已获进口医疗器械注册证的第二类、第三类医疗器械/体外诊断试剂
境内注册人主体资格
1、 进口医疗器械注册人在中国境内设立的外商控股投资企业
2、 中国境内企业控股境外注册人的,可由控股境外注册人的中国境内企业作为境内注册申请人
注册申报材料
1、 申请人应当按照《医疗器械注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局2014年第43号公告)、《体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局2014年第44号公告)等要求提交注册申报资料。
2、 下述注册申报资料可提交进口医疗器械的原注册申报资料:
a) 对于医疗器械产品:综述资料、研究资料、临床评价资料、产品风险分析资料;
b) 对于体外诊断试剂产品:综述资料、主要原材料的研究资料、分析性能评估资料、阳性判断值或参考区间确定资料、稳定性研究资料、临床评价资料、产品风险分析资料。
3、 一致性声明:境外注册人和境内注册申请人应当确保上述注册申报资料与境外注册人提交的原注册申报资料一致。
注册体系
核查要求
1、 注册申请人应当提供产品在境外生产质量管理体系的相关资料。
2、 药品监管部门在现场核查时重点关注境内生产质量管理体系与境外质量管理体系在设计开发、采购控制、生产控制、质量控制要求等方面的一致性、溯源性。
3、 医疗器械生产许可的现场检查可以与注册体系核查同步进行,避免重复核查。
上市后
监管要求
1、 取得医疗器械注册证的境内注册人应当按照《医疗器械生产监督管理办法》的相关要求和程序办理生产许可证。
2、 境内注册人承担医疗器械产品质量安全的主体责任,并负责医疗器械全生命周期的质量管理。
三、要点评析
1、进口医疗器械产品的国产化注册更为便捷
《征求意见稿》最大的亮点在于允许已获注册的进口医疗器械产品较为便捷地实现国产化注册。如前所述,进口医疗器械目前如需实现国产化,需要从头走完境内医疗器械的注册申报流程,耗时耗力。《征求意见稿》规定,在境内注册人进行境内医疗器械注册申请时,可提交进口医疗器械的原注册申报资料,包括临床评价资料。临床评价的进一步简化将为进口医疗器械的国产化提供更多便利。《征求意见稿》实施后,相信会有一批境外器械厂商选择将一些进口品种许可或转让给境内控股企业,由境内控股企业作为境内注册人推进国产化,达到优化供应链条,降低生产成本的目的。具体模式参见下图一:
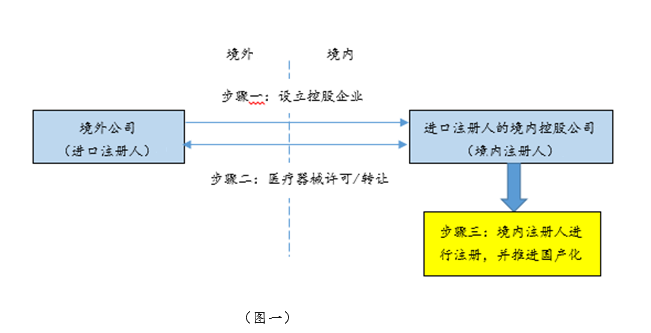
对于希望把一些品种在中国的商业化权利剥离出售的境外器械厂商,可能会采取先与购买方成立合资公司,将产品品种先转由境内控股合资公司持证、生产,然后再出售合资公司股权的方式来实现商业化权利的转移。具体模式参见下图二:
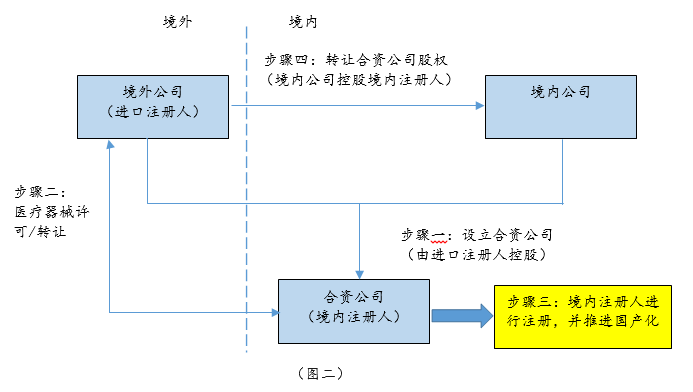
2、境内注册与生产暂不能分离
略有遗憾的是,《征求意见稿》要求境内注册人在取得注册证后,必须办理相应的生产许可。也就是说,境内注册人需要同时具备生产能力。这一点与目前正积极推进的医疗器械注册人改革所倡导的注册与生产相分离的理念有所差异,也会增加进口医疗器械转国产化生产的操作成本。这可能是药监局出于稳步推进改革,防止申请人滥用制度规避监管的审慎考虑。如有需要,境内注册人可考虑在境内医疗器械注册完成后另行寻求委托生产安排。
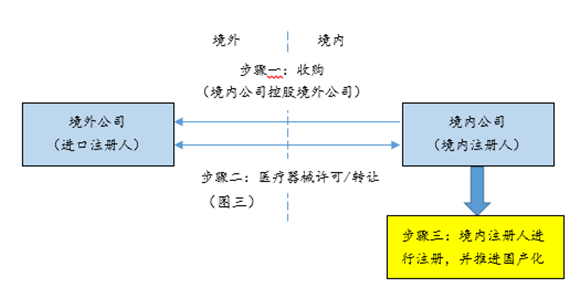
3、通过海外并购获得品种并国产化
除进口注册人设立的外商控股投资企业可担任境内注册人以外,《征求意见稿》特别提及,对于中国境内企业控股的进口注册人,可由该中国境内企业作为境内注册人。因此,具有国际战略的境内器械企业可以通过并购进口注册人股权的方式间接获得已有进口注册证的品种,然后通过《征求意见稿》设计的路径快速实现该品种的国产化。具体模式参见下图三:
4、境外注册人义务
另外需要注意的是,在境内注册人的注册申请过程中,境外注册人需要承担一些协助义务。根据《征求意见稿》,境内注册人提交的注册申报资料中,应当包括境外注册人提供的如下声明文件:(1)同意注册申报的声明或授权文件,声明同意境内注册人进行注册申报,承担相关生产、法律责任,授权境内注册人使用相应进口产品注册申报资料;(2)质量管理体系一致性声明,声明申请注册产品与相应进口产品生产质量管理体系在设计和开发、采购控制、生产控制、质量控制等方面的一致性;以及(3)所提交资料真实性的自我保证声明。境外注册人应当注意提供以上声明可能导致的法律责任,并寻求境内注册人或者合作方对其提供该等声明给予补偿。
四、结语
总体来说,药监局此次发布的《征求意见稿》是加速进口医疗器械国产化的一项突破。它简化了已获得进口注册的医疗器械的国产化注册程序,使境内注册申请人不必重复走流程,体现了监管部门“简政放权”的执政理念。如《征求意见稿》正式实施,将加速进口医疗器械的国产化,对化解医疗器械产能过剩、促进国产器械的创新发展起到促进和推动作用,增加医疗器械的可及性,更好地满足公众的健康需求。
《征求意见稿》征求意见的时间截止2020年3月31日,不排除后续会根据公众意见有进一步的修改。我们将持续关注最终出台的正式文件的最新进展。












