美国医疗器械市场准入研究
2018.02.27 马锋
美国医疗器械市场准入-法律法规体系
法律
The Food, Drug and Cosmetic Act (“食品、药品和化妆品法”)
美国国会于1938年通过,该法增加了对医疗器械的管理
多次修改
通过1976年的修改,加强了对医疗器械的管理
行政法规
Code of Federal Regulations – Title 21 – Food and Drugs (美国联邦法规-第21篇-食品和药品)
与医疗器械相关的部分主要是第800-898条(Parts 800-898)
美国医疗器械市场准入主要管理部门-美国食品药品管理局
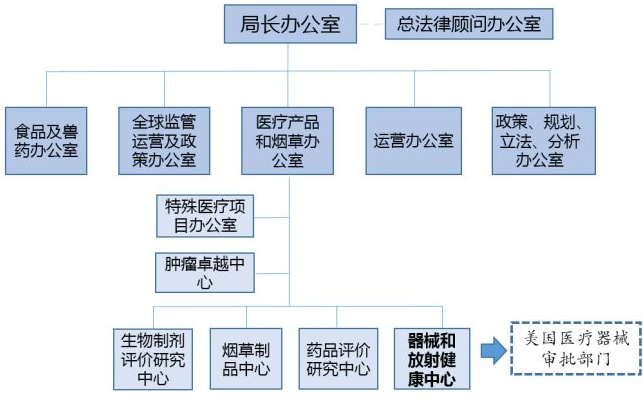
*因篇幅所限,美国FDA的部分机构未在此图中反映。
美国医疗器械准入 – 分类管理
I类医疗器械
风险程度低
常规管理
II类医疗器械
具有中度或高度风险
需要常规管理和特别措施管理
III类医疗器械
具有高风险
需要上市并全面安全性和有效性审查
I类医疗器械
大部分I类医疗器械免于FDA审批
少数需提交510(k)申请
II类医疗器械
有些II类医疗器械免于FDA审批
大部分需提交510(k)申请
III类医疗器械
FDA 上市申请审批
美国医疗器械准入 – 基本要求
免于FDA审批
美国FDA的豁免510(k)申请医疗器械清单(大部分I类医疗器械和部分II类医疗器械)
510(k)申请
申请中需阐述相关医疗器械与已经上市的某一产品在安全性和有效性方面“实质性等同”(Substantially Equivalent)
已上市产品是指:(i) 1976年5月28日前合法上市的,(ii)从III类医疗器械被重新划分到II类或I类的,和(iii)经过510(k)审查并通过的。
上市申请审批
FDA对产品的安全性和有效性进行全面审查。
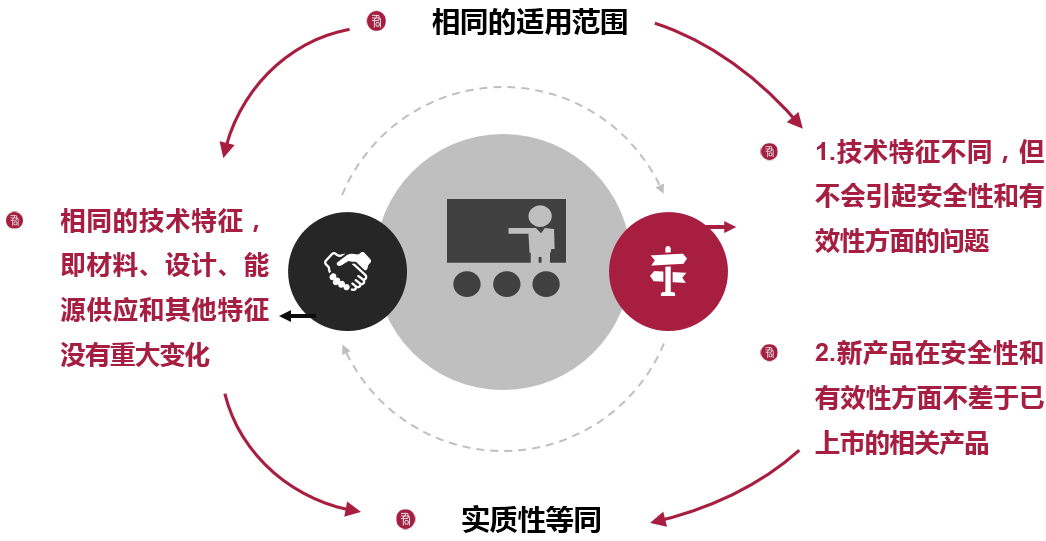
美国医疗器械准入 – 医疗器械上市申请审批
由FDA进行上市申请审批的医疗器械,很多需要进行临床试验
在美国进行临床试验,必须遵守美国临床试验操作规程
在美国进行临床试验的,必须有美国的申办者
在美国境外进行临床试验,必须遵守所在地国家的法律规定,或者《世界医学大会赫尔辛基宣言》的要求
美国医疗器械准入 – 产品检测和临床资料
1、有新的适应症(相同适用范围)
2、与比较器械有重大技术上的不同
3、非临床测试和评估不适用
美国医疗器械准入 – 临床试验
在美国进行的临床试验一般须经FDA批准,申请时需提交
1、机构伦理委员会批准的临床试验计划
2、所有参与试验者的知情同意书
3、相关医疗器械仅限于临床试验使用的说明和声明
4、对相关临床试验的监督
5、要求的相关记录和报告
美国医疗器械准入 – 技术问题争议
器械和放射健康中心内部复审
10天内提交上一级复审,该上一级在45天内审查并作出决定,决定必须书面记录并归档
可以一直上报,直到中心的负责人
FDA内部复审
穷尽中心内部复审机制后,可以在10日内提交FDA科学争议程序复审委员会(Scientific Dispute Process Review Board)
外部专家
也可以要求外部专家参与审查决定
美国医疗器械准入 – 其他要求
包括境外生产企业
在医疗器械用于商业用途30天之内
违者产品可能在海关被扣
每年登记,信息随时可以更新
列明产品
所有登记者必须将其生产或经营的产品列出
FDA认可审查机构
510(k)也可由FDA认可的第三方审查机构审查
须向第三方审查机构交纳服务费用
第三方审查机构提建议,FDA作出决定
美国医疗器械准入 – 其他要求 – 注册用户费
| 适用于有医疗器械在美国销售的所有企业(包括境外企业) | ||
| 收费项目 | 标准收费(美元) | 小企业收费(美元) |
| 年度生产地登记 | 4,624 | 4,624 |
| 510(k) | 10,566 | 2,642 |
| … | … | … |
| … | … | … |
收费标准每年调整,以上为2018年收费标准
年销售额在30万美元或以下的企业第一次提出上市申请审批时,该项目的收费可免交
如果510(k) 是通过FDA认可的审查机构审查,该项目的收费可免交
美国医疗器械准入 – 起诉FDA
案例分析
1、Ivy Sports Medicine, LLC v. Sebelius (2013)
2、基本事实:Ivy Sports Medicine, LLC于2008年12月取得FDA的510(k)批准,2011年3月30日,FDA撤销了已经批准的501(k),要求相关产品按上市申请全面评审。
3、Ivy Sports Medicine, LLC 起诉认为FDA依法没有权利撤销已经批准的510(k)决定。
4、法庭决定:FDA有权撤销510(k)决定。











